截至目前全球至少已有 77 个国家和地区报告发现奥密克戎毒株(英文名:Omicron)感染病例。这个由 2019 新型冠状病毒(SARS-CoV-2)变异而来的毒株很可能会比目前在全球范围内感染率极高的德尔塔毒株免疫逃逸能力更强,其传染力比德尔塔毒株增加了 37.5% 左右,世界卫生组织(WHO)将奥密克戎列为需要关注的变异毒株。
奥密克戎首例确诊感染病例,是 2021 年 11 月 9 日在南非采集的标本中被首次发现,变异毒株德尔塔(delta)的刺突蛋白突变数量为 15 处,而奥密克戎为 32 处。刺突蛋白的主要功能是结合人体细胞表面的受体、促进融合、实现侵入。刺突蛋白突变数量增多,意味着这种病毒更易侵入人体,传染性进一步增强,病毒变体也可能绕过人体的免疫系统,同时也会使免疫细胞更难攻击病原体。
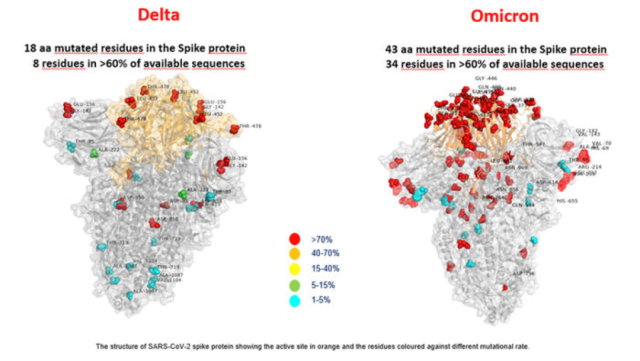
奥密克戎与德尔塔刺突蛋白突变数量对比
叠加变种而来的奥密克戎毒株,使全球新冠疫情防控局势不容乐观,而近期全球两个关于疫苗对奥密克戎毒株中和效力的重要研究,确认了其具有很强的免疫逃逸能力,有可能是至今为止所有变异体中最强的。由奥密克戎等变异毒株带来的严重威胁,急需通过新冠治疗特效药物与免疫疫苗共同搭建更安全有效的防控体系。
随着德尔塔变异毒株的到来,使美国本年度第三季度住院人数出现激增。2020 年 10 月,美国食品药品管理局(FDA)批准了吉利德科学的抗病毒药物 Veklury®(瑞德西韦, remdesivir) 用于治疗新冠住院患者,成为美国首个正式获批的新冠治疗药物。
短短一年时间,瑞德西韦的累计销售额达就到了惊人的 70 亿美元(2020 年 28 亿美元;2021 年至 42 亿美元),而吉利德对瑞德西韦的整年销售预期也在 10 月份被再次更新,提升至 45-48 亿美元,2021 三季度销售额环比上涨 132% 。瑞德西韦在销售收入上获得的高增长主要依赖于住院人数的增加。

吉利德 Q3 季报,2021,https://investors.gilead.com/static-files/cf9f2815-947e-4d97-adcc-7d50ee064075/
瑞德西韦属于一种核苷类的抗病毒药物,其主要作用机理是抑制病毒 RNA 聚合酶的活性,从而达到抑制病毒 RNA 复制的作用。
近期因注射液中含有玻璃颗粒被客户投诉陷入召回风波的瑞德西韦,虽然上市以来被寄以厚望,但却争议不断。世界卫生组织于今年 11 月份发表声明说,不论新冠住院患者病情多严重,都不建议使用抗病毒药物瑞德西韦进行治疗,因为目前尚无证据表明该药能提高患者生存率或降低患者对呼吸机的需求等。作为新冠药物的瑞德西韦在临床治疗上的效果,从目前掌握的情况来看,尚有待考量。
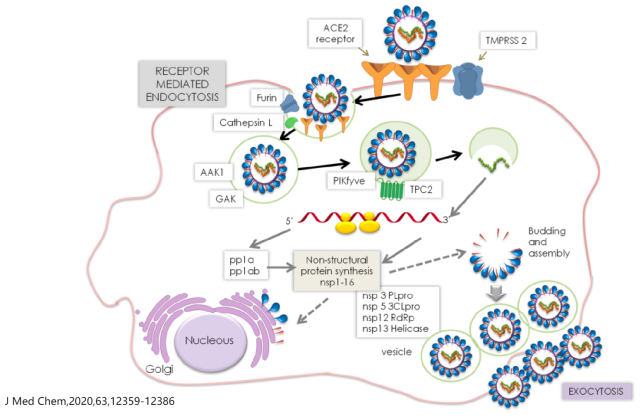
目前新冠治疗抗病毒药物的研发可以划分为中和抗体和小分子药等,新冠中和抗体类药物的主要作用机制是中和新冠病毒,阻止病毒吸附和进入易感细胞,从而阻断病毒或其遗传物质进入胞内增殖。而小分子药物的作用机制比较多样,大多通过干扰病毒自身的复制来达到消灭病毒的效果,目前进展较快的分别是 RNA 聚合酶抑制剂、雄激素受体拮抗剂以及 3CL 蛋白酶抑制剂(3C-likeprotease,3CLpro)。
针对 3CL 蛋白酶靶点开发抗新冠病毒药物的优势
3CL 蛋白酶是新冠病毒复制所必须的酶,是抗新冠病毒小分子药物开发的重要靶点,3CL 蛋白酶也是在病毒自身编码中剪切和加工 RNA 的主要蛋白酶,目前人们对 SARS 病毒和新型冠状病毒(SARS-COV-2)的 3CL 蛋白酶结构研究最多。在疫情爆发初期,国内创新型生物医药企业前沿生物(股票代码:688221.SH)即开展前瞻性抗新冠病毒候选药物的研发布局,目前其在研、针对住院患者的抗新冠病毒新药 FB2001 进度在全球相对领先。
FB2001 为新型冠状病毒(SARS-CoV-2)蛋白酶抑制剂,是基于冠状病毒主蛋白酶(3CL 蛋白酶)三维结构设计合成的拟肽类化合物,具有高效靶向抑制冠状病毒主蛋白酶、以及体外抗新冠病毒的活性,通过抑制 3CL 蛋白酶的催化功能而抑制病毒多聚蛋白前体的切割,阻断病毒复制,抑制子代病毒生成,其独特作用机制使其活性理论上不受任何目前集中在病毒 S 蛋白突变影响,更具稀缺性和独立性。
研究显示,FB2001 在实验动物体内展现出良好的体内抗病毒效果、药代动力学特征和安全性,上述研究成果已发表于国际权威期刊《科学》(Science)并作为封面文章刊登。目前 FB2001 正在美国开展 I 期临床试验,采用单中心、随机、盲法、安慰剂对照设计,主要目的为评价 FB2001 在人体的耐受性、安全性和药代动力学特征。
FB2001 的主要目标人群为新冠肺炎住院患者,在临床应用与产品剂型上,对标的竞品是瑞德西韦。但二者在作用机制上明显不同,FB2001 作为 3CL 蛋白酶抑制剂具有底物专一性,人体细胞中没有 3CLpro 的同源蛋白,其抑制剂对宿主具有潜在良好的安全性,从作用机制上,FB2001 的临床预期效果将更具优势。从全球市场来看,目前仅有瑞德西韦一款药物可以用于针对新冠住院患者的临床治疗,FB2001 具备临床稀缺性。
日前,国家药品监督管理局(简称「国家药监局」)核准签发前沿生物的《药物临床试验批准通知书》,注射用抗新冠病毒药物 FB2001 在国内开展药物临床 I 期桥接试验申请获批。作为目前国内唯一进入临床试验阶段的蛋白酶抑制剂,其临床试验的获批将进一步推进在中国的研发进程。FB2001 作为小分子类药物,在生产制备和化学合成环节相对容易,且生产成本优势明显,结合对瑞德西韦上市后的样本市场分析,FB2001 在作用机制、生产工艺和制造成本上均具明显优势,未来上市后的市场空间值得期待。
在这场事关全球公共卫生防御体系的战役,也是在人类生命健康面前与病毒争分夺秒的赛跑,我们更加期待 FB2001 的科创成果早日转化,跑在病毒之前,守卫人类健康。